Attraktive und sichere chemische Experimente im Zusammenhang mit Rahmenlehrplänen
Chemolumineszenz
Chemolumineszenz ist eine Erscheinung, bei der es aufgrund einer chemischen Reaktion zur Emission des kalten Lichts kommt. Während einer chemolumineszenten Reaktion entsteht aus den Edukten ein reaktives Intermediat, das sich in einem energetisch reichen, angeregten Zustand befindet. Die anschliessende Rückkehr in den Grundzustand ist durch die Emission eines Lichtquantums begleitet. Dieses Szenario ist im Schema 1 abgebildet:

Stoffe A und B reagieren miteinander unter Bildung der Produkte C* und D, wobei das Produkt C* sich im energetisch reichen oder elektronisch angeregten Zustand befindet. C* kann seine überschüssige Energie auf mehrere Weisen loswerden:
- nichtproduktiver nichtstrahlender Übergang unter Bildung von Wärme (unerwünschter Prozess)
- direkte Deexzitation von C* durch einen strahlenden Übergang, der für C* charakteristisch ist. Das Emissionsspektrum ist abhängig von der Struktur von C.
- indirekte Deexzitation von C* durch einen strahlenden Übergang – C* gibt seine überschüssige Energie an ein geeignetes Fluoreszenzmolekül ab, das sie effektiv übernehmen und anschliessend ausstrahlen kann. Das Spektrum der Lichtemisssion ist dann abhängig von der Struktur des Fluoreszfarbstoffes und nicht mehr von der Struktur von C.

Wie schon in der Einleitung erwähnt wurde, das wohlbekannteste und relativ gut dokumentierte Beispiel einer vom Menschen gezielt hervorgerufenen Chemolumineszenz war die Entdeckung vom Element Phosphor durch den hamburger Alchemisten H. Brand. Die im dunklen grün leuchtende wachsartige Substanz – weisser Phosphor – wird bei Raumtemperatur an ihrer Oberfläche langsam oxidiert, wobei sich in der Gasphase angeregte reaktive Intermediate (PO)2 und HPO bilden, die für das grünliche Leuchten verantwortlich sind.
Der Ausdruck Phosphoreszenz wird unglücklicherweise mit der Oxidation von Phosphor verbunden, obwohl Phosphoreszenz eine rein physikalische Erscheinung darstellt, wie im Kapitel Phosphoreszenz erklärt wurde.
Die heutige Chemie kennt eine Vielzahl chemischer Reaktionen, bei denen es zur Chemolumineszenz kommt. Zu diesen Reaktion zählen die Oxidation von Luminol mit Wasserstoffperoxid, die Oxidation von Siloxenen, Reduktion von RuIII Komplexen durch Tetrahydridoboratanion, Oxidation von Lophin, Lucigenin, die Oxidation von Pyrogallol durch Wasserstoffperoxid in Gegenwart von Formaldehyd (die sogenannte Trautz-Schorigin Reaktion) und Chemolumineszenz des Singulett-Sauerstoffs. Die wohlgrösste kommerzielle Vebreitung aber fanden erst die aktivierten phenolischen Ester der Oxalsäure, deren Chemie am meisten durch den amerikanischen Chemiker M. Rauhut in den Sechzigern erforscht wurden (American Cyanamide Company). Die Chemie dieser Ester wird kommerziell in Knicklichtern genutzt.
Der Erfolg der Reaktion der Diaryloxalate mit Wasserstoffperoxid liegt in der hohen Wirksamkeit, einem relativ niedrigem Preis (im Vergleich mit anderen Systemen) und der Möglichkeit, durch Zugabe eines geeigneten Fluoreszenzfarbstoffes praktisch jede Lichtfarbe zu erhalten, von blau bis hin zu infrarot. Es wurde gemessen, dass bis 23% der chemischen Energie dieser Systeme ins Licht umgewandelt wird, was am höchsten von allen nichtenzymatischen Systemen ist.
Die in der Literatur wohlbekanntesten Beispiele der Diaryloxalate schliessen die Ester DNPO (bis-(2,4-Dinitrophenyl)oxalat) und TCPO (bis-(2,4,6-Trichlorphenyl)oxalat ein. Diese Ester werden zwar in analytischer Chemie routinemässig eingesetzt, ihr Einsatz zur Demonstration in Schulen ist aber weniger geeignet, da durch ihre Reaktion mit Wasserstoffperoxid hochgiftige (2,4-Dinitrophenol) oder übelriechende Phenole entstehen (2,4,6-Trichlorphenol). Die in diesem didaktischen Schulbaukasten enthaltene, nicht-toxische und angenehm riechende Alternative – bis-Vanillyloxalat (BVO), ein Ester der Oxalsäure und des Vanillins, weist ein ähnliches chemisches Verhalten auf, ist aber frei von diesen Nachteilen.
Der allgemein akzeptierte Mechanismus dieser chemischen Reaktion ist im Schema 2 abgebildet:
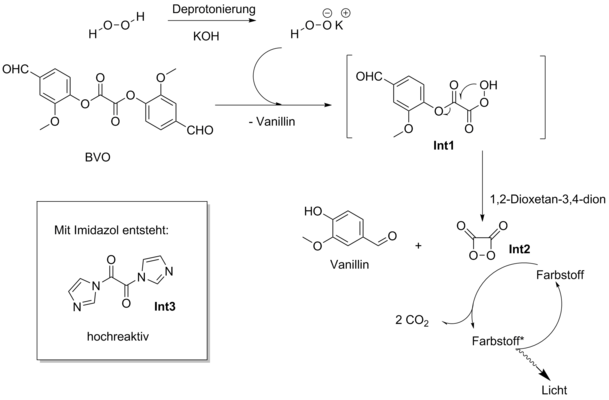
Wasserstoffperoxid wird durch eine Base (hier Kaliumhydroxid) zum Hydroperoxidanion deprotoniert. Das Hydroperoxidanion zeichnet sich durch eine deutlich höhere Reaktivität als Wasserstoffperoxid selbst aus. Dieses Anion reagiert anschliessend mit BVO; im ersten Schritt der Reaktion kommt es zur Abspaltung eines Vanillinmoleküls und zur Bildung des halbreagierten Intermediats Int1, der durch intramolekulare Zyklisierung ein weiteres Vanillinmolekül abspaltet und einen gespannten Vierring 1,2-dioxetan-3,4-dion bildet (Intermediat Int2). Dieser Stoff ist eine sehr instabile, energetisch reiche Verbindung, die ihre überschüssige Energie an ein Farbstoffmolekül abgibt, das dann angeregt wird. Während dieses Prozesses zersetzt sich Int2 in zwei stabile Kohlenstoffdioxidmoleküle. Das angeregte Farbstoffmolekül verliert seine Anregungsenergie in Form von Licht.
Ausser Katalyse durch Base (KOH, Kalium oder Natriumacetat, Natriumsalicylat, usw.) wird die Reaktion auch durch nukleophile Katalysatoren beschleunigt, wie z.B. 4-Dialkylaminopyridine oder Imidazol. Der katalytische Effekt von Imidazol beruht auf seiner Fähigkeit, BVO in das viel reaktivere bis-Imidazolyloxalat (Intermediat Int3) überzuführen, das mit Wasserstoffperoxid um eine Grössenordnung schneller reagiert.
Die Peroxyoxalat-chemolumineszenzreaktion bietet zahlreiche Möglichkeiten für didaktische Zwecke. Mit Hilfe dieser Reaktion lässt sich eine Vielzahl chemischer Gesetze, wie. z.B. Grenzphasentransportphänomene, die Abhängigkeit der Reaktionsgeschwindigkeit vom Mischen, Temperatur, Gegenwart von Katalysatoren, Inhbitoren, usw. demonstrieren.
Im Allgemeinen gilt es, dass Messungen der geringsten Lichtmengen sehr empfindlich sind. Deswegen können mit Hilfe von chemolumineszenten Reaktionen auch Spurenkonzentrationen chemischer Verbindungen gemessen werden und deshalb ist es kein Wunder, dass analytische Chemie das Hauptanwendungsgebiet der Chemolumineszenz ist. In der Kriminalistik ist zum Beispiel die Reaktion des Luminols mit Wasserstoffperoxid in Gegenwart von Eisenspuren bekannt. Da Eisen im Blut enthalten ist, ist es möglich, mit einem Luminol-Wasserstoffperoxidgemisch auch die schwächsten Blutflecken zu entdecken.
Ausser der Möglichkeit, sehr tiefe Wasserstoffperoxidkonzentration mit Peroxyoxalat-chemolumineszenz zu messen, sind viele andere für die chemische Analytik nützliche Reaktionen bekannt. Ein solches Beispiel ist die Bestimmung von Stickstoffmonoxid (NO) in der Luft durch die Reaktion mit Ozon. Die genaue und schnelle Bestimmung der Konzentration von NO ist von grosser Bedeutung für eine Realzeitüberwachung der Luftqualität.






